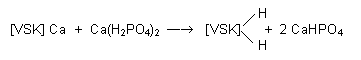Živinný režim půd
|
| makroelementy v půdě | mikroelementy v půdě | užitečné prvky | těžké kovy v půdě | |
||
|
| dusík | fosfor | draslík | vápník | hořčík | síra |
Obsah veškerého fosforu v půdách kolísá od 0,03-0,13% P
(0,07-0,29% P205). Fosfor v přírodě se
vyskytuje vždy ve svém nejvyšším oxidačním stupni, jakožto
aniont kyseliny ortofosforečné PO43-.
V
půdě je fosfor obsažen ve formách anorganických i organických.
Agronomicky nejvýznamnějším přirozeným zdrojem fosforu v půdě
je primární minerál apatit. Ve všech magmatických horninách se tento minerál
vyskytuje jako rozptýlené různé formy fluor-, chlór- a
hydroxylapatitu (Ca5(PO4)3.F,Cl,OH).
V menší míře se vyskytují v půdách také primární minerály
fosforečnanu železa a příměsí Mn - tripity
nebo vodnaté forsforečnany hliníku - wawelity.
V málo provzdušených, zamokřených půdách může se také
vyskytovat fosforečnan železnatý - vivianit
Fe3(PO4)2.8H2O.
Zvětráváním
apatitů i jiných primárních fosfátových minerálů se uvolňují
anionty kyseliny ortofosforečné, které přecházejí do jiných,
tzv. sekundárních, velmi rozmanitých forem minerální nebo
organické povahy, z nichž některé slouží jako zdroj fosforu
pro výživu rostlin.
Podíl
minerálních sloučenin
fosforu v půdě značně kolísá v závislosti na druhu a typu půdy,
hloubce profilu půdy, úrovni fosforečného hnojení a podobně. V
našich podmínkách mírného pásma obsah fosforu v minerálních
vazbách tvoří zpravidla více jak polovinu veškerého množství
P v zemědělsky využívancýh půdách. Převážná část minerálních
sloučenin fosforu v půdě je ve formách ve vodě nerozpustných,
a proto fosfor z nich je pro rostliny málo přístupný. Podíl
vodorozpustných sloučenin je velmi malý a činí jen asi 0,8-8 mg
P na 1kg na vzduchu vyschlé půdy. Tvoří jej fosforečnany
jednomocncýh kationtů, dihydrogenfosforečnan vápenatý aj.
Kromě
již zmíněných původních primárních minerálů, vytvořily se
v půdě v důsledku jejich zvětrávání nové sekundární fosfátové
minerály. Děje se tak převážně chemickými reakcemi, tj. srážením
volných fosfátových iontů v půdním roztoku, minerálními
sorbenty, především ionty a aktivními sloučeninami Ca, Al a Fe.
Tvorba a rovnovážný stav mezi jednotlivými formami minerálních
fosforečnanů závisí také, a to ve značné míře, na půdní
reakci -pH. Se stoupající hodnotou pH se zvyšuje množství
Ca-fosfátů.
V
alkalických a neutrálních půdách (někdy až slabě kyselých)
jsou nejčastější formou fosforečnanů: hydrogenfosforečnan vápenatý
CaHPO4, oktokalciumfosfát Ca4H(PO4)3.
2H2O, hydroxylapatit Ca5(PO4)3.OH,
fluorapatit Ca5(PO4)3.F, karbonátapatit
Ca10(PO4)6. CO3, případně
i grandalit CaAl3(PO4)2(OH)5,
které jsou také většinou výslednými produkty přeměn fosforečných
hnojiv v těchto půdách. Význam výše uvedených fosfátů jako
zdrojů P pro rostliny je dán především produkty jejich
rozpustnosti, podle nichž je možno sestavit následující řadu s
klesající rozpustností: hydrogenfosforečnan vápenatý >
oktokalciumfosfát >
hydroxylapatit >
karbonátapatit >
fluorapatit. V půdách s neutrální až alkalickou reakcí je tedy
odpovědný za sorpci P v minerálních vazbách především vápník.
Na
těchto půdách probíhá poutání dodaného P nebo v půdě obsaženého
vodorozpustného fosforu podle následující reakce: Vzniklý
hydrogenfosforečnan vápenatý se skutečně v těchto půdách také
nachází a může reagovat s dalším Ca z výměnného sorpčního
komplexu až na Ca3(PO4)2. Vedle
toho může docházet k reakci Ca(H2PO4)2
s Ca(HCO3)2, případně až k tvorbě
trikalcium fosfátu (retrogradace P2O5).
Reakce probíhá podle rovnice:
Ca(H2PO4)2
+ Ca(HCO3)2
------->
2 Ca HPO4 +
2 H2CO3,
2
Ca HPO4 +
Ca(HCO3)2
------->
Ca3(PO4)2
+ 2 H2CO3
nebo
Ca(H2PO4)2
+ 2 Ca(HCO3)2
------->
Ca3(PO4)2
+ 4 H2CO3
Podmínky
pro vznik Ca3(PO4)2 jsou v půdě
omezené, a proto vzniká často kombinace Ca3(PO4)2.CaHPO4.3H2O,
který bývá označován jako oktokalciumfosfát Ca4H(PO4)3.
Vznik těžce rozpustného trikalcium fosfátu je třeba agronomickými
zásahy omezovat. K tomu přispívá střídání plodin a zařazování
bobovitých do osevních sledů, které v důsledku agresivnějších
kořenových exkretů mohou využít a zpřístupnit větší část
méně rozpustných P sloučenin v půdě.
V
kyselých půdách je fosfor vázán hlavně na dihydroxyl-dihydrogen
fosforečnany Al a Fe, což jsou stabilní krystalické minerály série:
variscit Al(OH)2.H2PO4, strengit Fe(OH)2.H2PO4
a jejich izomorfní směs barrandit.
Chemická
sorpce fosforu v kyselých půdách probíhá tedy jako srážení
rozpuštěných fosfátových iontů ionty železa a hliníku přes
řadu metastabilních meziproduktů typu oxi- a hydroxifosfátů Al
a Fe. Ve starší literatuře bylo chování fosforu s Al a Fe označováno
za zvrhávání kyseliny fosforečné.
Pro
omezení přeměn fosforu na méně rozpustné formy, doporučujeme
zařazovat do osevního sledu bobovité rostliny, jejichž agresivnější
kořenové exudáty a intentzivnější sorpční schopnost kořenů
umožní využít značnou část fosforu i z méně rozpustných
vazeb. Dále se doporučuje pravidelně zapravovat do půdy
organickou hmotu, která zvyšuje biologickou aktivitu půd, a tím
dochází přes CO2 k vratným reakcím. Také organické
látky vyvazují anorganický P do labilnějších organických
vazeb. Vedle toho dochází k odčerpání volného vápníku do
humusových látek, a tím se udržuje doba, po kterou je H2PO4-
v půdním roztoku (humusový efekt). U kyselých půd je
proto třeba s náležitým předstihem před hnojením fosforečnými
hnojivy půdy vyvápnit.
Organický fosfor představuje podstatnou část z celkového obsahu
P v půdě. V jeho zastoupení jsou mezi různými půdami značné
rozdíly (od 10 do 80%). Z organických fosfátů, které byly v půdě
identifikovány, nacházíme nejčastěji fytin (m-inositol-hexafosfát),
dále fosfolipidy, nukleinové kyseliny a nukleoproteidy,
fosforylované pyrimidinové sloučeniny a fosforylované cukry.
Největší část organicky vázaného P tvoří fytin a jeho soli
fytáty, přičemž v kyselých půdách převládají fytáty železa
a hliníku, v půdách zásaditých fytát vápníku. Fytin je
chemicky velmi málo reaktivní a půdou téměř nemigruje. Je pokládán
za potenciální zdroj využitelného P pro rostliny. V půdách s
travním porostem organicky vázaný fosfor převládá a dosahuje někdy
až 80% z veškeré zásoby P v půdě.
Biochemicky
nejvýznamnější a nejreaktivnější organické sloučeniny P v půdě
jsou fosforylované sacharidy, zejména triózy a hexózy a
fosforylované pyrimidinové sloučeniny. Jsou nositeli velkých
kvant biochemicky využitelné energie, která je potřebná při
mnoha reakcích v půdě. Protože vazba mezi fosfátem a organickou
složkou je bohatá energií, je zároveň málo stabilní a fosfátový
iont se z těchto látek snadno uvolňuje a stává se pro rostliny
dobře využitelný.
Fosforylace
a defosforylace organických látek jsou nejdůležitějším článkem
přeměn energie v procesu látkového metabolismu v půdě. Zvýšené
množství fosforu v půdě snižuje energetické ztráty (ve formě
tepla) a zlepšuje produktivitu všech endoergických pochodů, především
humifikaci. Tím fosfor působí na zlepšení bilance půdní
organické hmoty a naopak půdní humus zlepšuje fyziologickou využitelnost
fosforu z půdy i hnojiv, zejména tím, že jej chrání před
reakcemi s Ca a těžkými kovy. Mechanismus tohoto účinku se většinou
vysvětluje tvorbou chelátových vazeb mezi složkami půdního
humusu a minerálními sorbenty fosfátových iontů. Ochranný účinek
humusu na fyziologickou funkci půdního fosforu je tedy nepřímý,
ale velmi výnamný a je podstatou tzv. „humusového efektu“,
který se projevuje tím, že přijatelnost P rostlinami za přítomnosti
humusových látek v půdním prostředí vzrůstá. Organicky vázaný
fosfor může mít za určitých podmínek značný význam pro
potenciální využitelnou zásobu P v půdě.
Poutání
fosforu v půdě je podmíněno v podstatě třemi druhy sorpční
schopnosti půdy: 1.
chemickou
sorpcí - srážení
fosfátových iontů z půdního roztoku dvojmocnými kationty za
vzniku méně rozpustných sekundárních anorganických fosfátů;
u trojmocných kationtů mohou vznikat těžce rozpustné fosfáty. 2.
fyzikálně
chemickou neboli výměnnou adsorpcí
- poutání fosfátových iontů na povrchu jílových a koloidních
částic, 3.
biologickou
sorpcí -
imobilizace fosforu životní činností mikroorganismů.
Celkový
výživný potenciál půdy, pokud jde o fosfor, je dán obsahem
tzv. přijatelných (labilních) forem P, souhrnně vyjadřovaných
jako faktor kapacity (Q). Pro bezprostřední příjem této
živiny rostlinami je však rozhodující momentální koncentrace
fosforečnanových iontů v půdním roztoku, obecně označovaná
jako faktor intenzity (I). V převážné většině případů
je koncentrace P v půdním roztoku velmi nízká, zpravidla se
pohybuje v rozmezí od 0,02 do 0,2 mg P na litr. Rostlina je tudíž
odkázána na neustálé doplňování půdního roztoku v aktivní
kořenové zóně fosfátovými ionty.
Jestliže
je fosfor z roztoku odčerpán rostlinami, musí být doplněn z tuhé
fáze labilním P a systém se upraví na nižší hladinu. Obsah
fosforu v půdním roztoku je třeba doplňovat co nejrychleji, aby
jeho nedostatek neomezoval výživu rostlin. Rychlost, kterou je půdní
roztok doplňován fosforem z labilních forem je charakterizována
tzv. kinetickým faktorem (R). V podstatě jde o množství
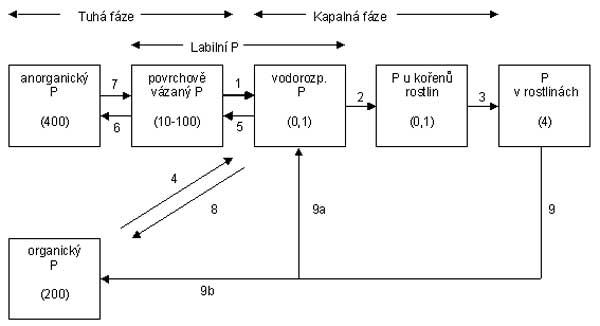
uvolňovaného (desorbovaného) fosfátu v závislosti na čase. Pro dosažení požadovaného stavu ve výživě rostlin fosforem a zlepšení využitelnosti P z dodaných hnojiv je třeba zabezpečit optimální úroveň všech výše uvedených parametrů fosfátového režimu půdy, tj. intenzity, kapacity, kinetického faktoru i pohybu fosfátových iontů v půdním prostředí. Z praktického hlediska to předpokládá správný způsob aplikace vhodného hnojiva s ohledem na dané půdní podmínky. Fosfátový režim v půdě znázorňuje obrázek Schéma fosfátového režimu
ve vztahu půda - rostlina (Russel 1988)
Pokud má fosfát sloužit k výživě rostlin musí být
obsažen v půdním roztoku. Jeho obsah je však obyčejně
velmi malý (10-5-10-8 M) a proto musí
být kontinuálně doplňován. Čísla v závorce uvádějí
obsahy fosfátu v µg
P.g-1 nebo mg.kg-1 zeminy v hloubce 0-40
cm při 30% objemové vodní kapacitě.
Část
fosfátových iontů, které jsou vázány v minerální formě v půdě,
jsou mobilizovány (1) a jejich obsah v půdním roztoku se snižuje.
Z roztoku fosfáty difundují ke kořenům (3). Desorpce je
reverzibilní (5), pokud obsah fosfátů v roztoku je vysoký,
ustavuje se rovnovážný stav. Procesy (6 a 7) dochází k přeměně
anorganického P do labilních forem. Procesy 4 a 8 jsou organické
fosfáty mineralizovány a imobilizovány. Fosfáty se vrací do půdy
kořeny rostlin a nadzemními částmi jak Panorg. (9a) a
Porg. (9b). Čísla v závorkách dokumentují, že
celkový obsah P v půdě je dostatečný přibližně pro 150
sklizní, avšak Russel zjistil, že množství P labilního,
dopravovaného ke kořenům, nevytváří podmínky pro optimální
výživu rostlin.
Roční
odběr fosforu různými druhy zemědělských plodin je značně
rozdílný a pohybuje se nejčastěji mezi 15-45 kg P na ha.
Vyplavování fosforu z půdy je velmi malé a ročně se ztratí u
půdy lehké 3-5 kg, střední 2-3 kg, těžké méně než 2 kg P
na ha. V erozních smyvech se dostává do povrchových vod a
sedimentů fosfor, který spolu s dusíkem může vyvolávat
eutrofizaci vod a jezer. Na ni se však značně podílí i znečistěné
odpadní vody (vesnice) a malé průmyslové podniky. |
||
|
autor textu: Prof. Ing. Rostislav Richter, DrSc. |
||
Poslední
aktualizace: 16.01.2007 17:15
 Dynamika fosfátů |
 Zásobenost půd ČR fosforem (AZP) |
 Eutrofizace povrchových vod |
Ústav agrochemie a výživy rostlin, MZLU v Brně, Zemědělská 1, 613 00 Brno