
Apoferritin: Nanotransportér pro cílené dopravování léčiv
Dita Münzová, Simona Dostálová, Markéta Vaculovičová, René Kizek
Rakovina je skupina nádorových onemocnění při kterém dochází k nekontrolovatelnému růstu a množení buněk, které ztrácí schopnost apoptózy 1. Aktuálně používané metody léčby, jako je chemoterapie, radioterapie nebo chirurgická léčba, nejsou dostačující co se týče efektivnosti a počtu vyléčených pacientů 2. To je zapříčiněno i používáním cytostatických léčiv, které zastavují růst buněk, a to jak rakovinných, tak i zdravých, což způsobuje mnoho vedlejších účinků doprovázejících léčbu 3. Mezi nejčastěji používaná cytostatická léčiva patří anthracyklinové antibiotikum doxorubicin, poškozující myokard, čímž zhoršuje srdeční činnost3. Z těchto důvodů se v poslední době přikládá velká pozornost studiu nanotransportérů a cílenému dopravování léčiv 4. Jako nanotransportéry mohou být použity zlaté nanočástice 5, lipozomy 6,7, kvantové tečky 8 nebo proteiny, jako je apoferritin. Cílené dopravování léčiv pomocí nanotransportérů je založeno na enkapsulaci cytostatického léčiva do dutiny nanotransportéru nebo navázání léčiva na jeho povrch9. Povrch nanotransportéru může být následně modifikován specifickým druhem protilátky, díky které se nanotransportéry dostanou na místo určení, kde je po změně podmínek (změna pH, teploty) léčivo uvolněno 3. Tím dochází ke snížení vedlejších účinků a působení léčiva pouze na nádorové buňky. Kromě cíleného dopravování léčiv vznikají další nové možnosti aplikací nanočástic jako použití při diagnostickém zobrazování 10,11. Kombinace diagnostického zobrazování a cíleného transportu formuje nový, perspektivní obor nanomedicíny 4 , teranostiku 12,13. Při pouhé modifikaci povrchu nanotransportéru protilátkami vzniká stericky nejednoznačný komplex, tudíž není zajištěno, že cílící protilátka bude navázána přes Fc region a její aktivní část správně geometricky orientována k vnějším antigenům. Z tohoto důvodu se tato práce zabývá modifikací povrchu a navázáním různých komponent na nanotransportér, prokázáním jejich vazby a důkazem selektivního cílení navrženého nanotrasportéru na nádorové buňky. Základem navrženého nanotransportéru byl protein apoferritin s enkapsulovaným anthracyklinovým antibiotikem doxorubicinem, který byl do apoferritinu uzavřen na základě změny pH. Další složkou nanotransportéru byly zlaté nanočástice, HWR peptid a specifická cílící protilátka. HWR peptid (HWRGWVC) byl vyroben v naší laboratoři a je odvozen od proteinu G, který má schopnost vázat protilátky prostřednictvím interakce s Fc regionem, což zaručuje správnou orientaci protilátky k vnějším antigenům14.
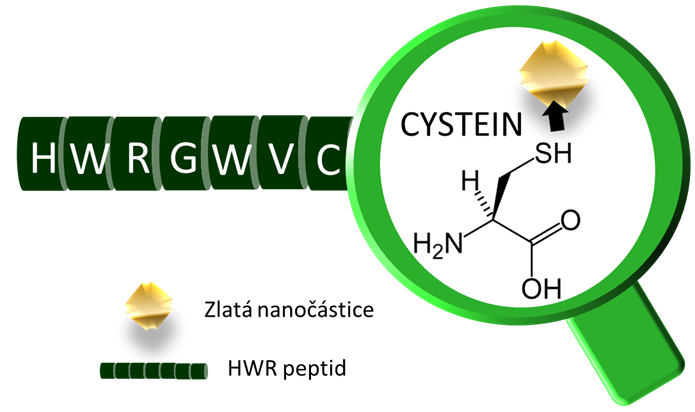 Obr. 1: Afinita zlata k SH skupinám cysteinu
Obr. 1: Afinita zlata k SH skupinám cysteinu
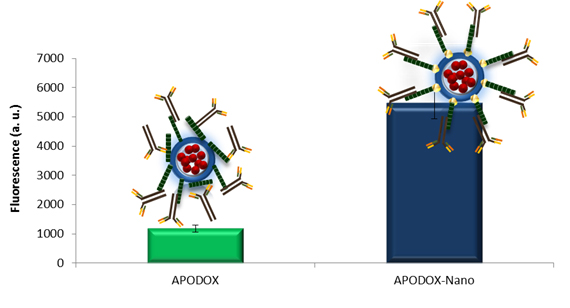 Obr. 2: Vliv modifikace zlatými nanočásticemi
Obr. 2: Vliv modifikace zlatými nanočásticemi
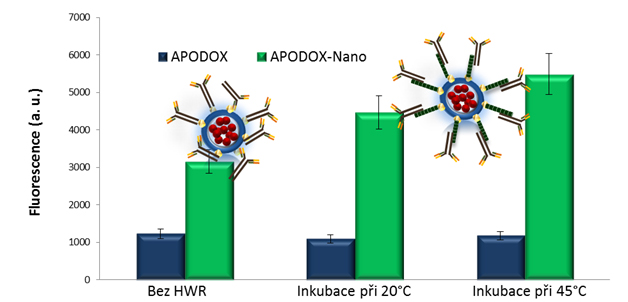 Obr. 3: Vliv použití HWR peptidu
Obr. 3: Vliv použití HWR peptidu
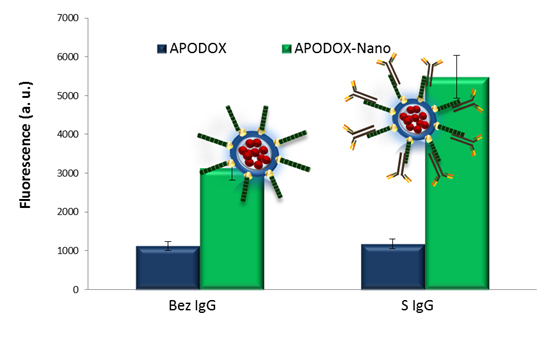 Obr. 4: Vliv použití IgG protilátky
Obr. 4: Vliv použití IgG protilátky
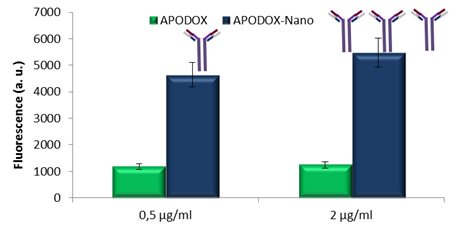 Obr. 5: Vliv koncentrace anti-IgG protilátky
Obr. 5: Vliv koncentrace anti-IgG protilátky
1. Ferrari M.: Nature Reviews Cancer, 5, 161 (2005).
2. Chomoucka J., Drbohlavova J., Huska D., Adam V., Kizek R., Hubalek J.: Pharmacological Research, 62, 144 (2010).
3. Drbohlavova J., Chomoucka J., Adam V., Ryvolova M., Eckschlager T., Hubalek J., Kizek R.: Current Drug Metabolism, 14, 547 (2013).
4. Kawasaki E. S., Player A.: Nanomedicine: Nanotechnology, Biology and Medicine, 1, 101 (2005).
5. Patra C. R., Bhattacharya R., Mukhopadhyay D., Mukherjee P.: Advanced Drug Delivery Reviews, 62, 346 (2010).
6. Hu Y. R., Li K., Wang L., Yin S. S., Zhang Z. Z., Zhang Y.: Journal of Controlled Release, 144, 75 (2010).
7. Malam Y., Loizidou M., Seifalian A. M.: Trends in Pharmacological Sciences, 30, 592 (2009).
8. Marchal F., Pic E., Pons T., Dubertret B., Bolotine L., Guillemin F.: Bulletin Du Cancer, 95, 1149 (2008).
9. Mishra B., Patel B. B., Tiwari S.: Nanomedicine-Nanotechnology Biology and Medicine, 6, 9 (2010).
10. Gu F. X., Karnik R., Wang A. Z., Alexis F., Levy-Nissenbaum E., Hong S., Langer R. S., Farokhzad O. C.: Nano Today, 2, 14 (2007).
11. Wang J. Q., Sui M. H., Fan W. M.: Current Drug Metabolism, 11, 129 (2010).
12. Sumer B., Gao J. M.: Nanomedicine, 3, 137 (2008).
13. Svenson S.: Molecular Pharmaceutics, 10, 848 (2013).
14. Janu L., Stanisavljevic M., Krizkova S., Sobrova P., Vaculovicova M., Kizek R., Adam V.: Electrophoresis, 34, 2725 (2013).
J.Met.Nano:
volume-1, issue-1
- Liposomální transportéry
- Moderní zobrazovací metody
- Apoferritin: Nanotransportér pro cílené dopravování léčiv
- Miniaturizované detekční systémy a jejich aplikace
- Detekce nukleových kyselin pomocí metody dot-blot
- Sledování role iontů kovů a metalothioneinu při vývoji prionových onemocnění
- Viry jako nanotransportéry léčiv
- MiRNA: Od biogeneze po využití v lékařství
- Shrnutí vzniku a mechanismu rezistence vůči těžkým kovům
- Prionové proteiny a jejich interakce s těžkými kovy
- Biosyntéza kvantových teček
- Zelená syntéza stříbrných a zlatých nanočástic pomocí extraktů z vyšších rostlin
- Vliv různych forem glutathionu na kulturu lactobacillus casei ssp. rhamnosus
 PDF
PDF