
Liposomální transportéry
Jana Houbová, Markéta Vaculovičová, René Kizek
Během posledních desetiletí se v nanomedicíně značně rozšířil zájem o používání liposomálních přenašečů, neboť vykazují pozitivní výsledky v klinické praxi. Liposomy jsou uzavřené, sférické membránové váčky tvořeny dvěma částmi s odlišnou rozpustností (hydrofobní a hydrofilní část), cholesterolem a lipidy, nejčastěji tělu vlastním lecitinem. Mohou obsahovat i další fosfolipidy (fosfatidylglycerol a fosfatidylethanolamin). Většina klinicky schválených lipsomů má průměr 50 až 300 nm. Kromě klinicky využívaných liposomů, se využívají i další skupiny. Nejmenší liposomy, neboli malé unilamelární vesikuly (SUV), mají rozměry zhruba mezi 20 - 50 nm. O něco větší jsou pak velké unilamelární vesikuly (LUV), s průměrem přibližně 100 nm. Multilamelární vesikuly (MLV) jsou další ve skupině lipsomů. Dosahující velikosti 100 nm - 20 µm. Největšími liposomy jsou pak multivesikulární vesikuly (MVV) o velikosti 100 nm - 20 µm1. Liposomy mají roli skoro ve všech biologických procesech. Fungují jako stavební částice nebo jako signální molekuly2. Ve složení liposomů hraje důležitou roli cholesterol, který má velký vliv na chování liposomů in vitro a in vivo3. Liposomy, jako transportéry léčiv, jsou schopny enkapsulovat danou látku či léčivo, které jsou následně cíleně uvolněny. Tento komplex nalézá své širší využití ve farmacii, biofarmacii a biofyzice (membránový a distribuční model), v kosmetických a dermatologických přípravcích ale hlavně v léčbě rakoviny, především rakoviny kůže, zhoubných novotvarů spojených s AIDS, rakoviny tlustého střeva a konečníku4. U transportérů jako jsou liposomy, ale i třeba proteiny, oligonukleotidy, biomolekuly nebo makromolekulární nosiče se často provádí PEGylace, což je strategie pro úspěšnější dodávku terapeutických léčiv. Jedná se o navázání polyethylenglykolu (PEG) na povrch liposomu. Takto upravený liposom vykazuje odlišnou farmakokinetiku, jako je například pomalejší eliminace z organismu. PEGylace zvyšuje velikost a molekulovou hmotnost konjugovaných biomolekul a zároveň zlepšuje jejich famakokinetiku, rozpustnost ve vodě, enzymatickou degradaci a imunogenní a antigenní reakce. PEGylace zároveň zlepšuje stabilitu, ale především permeační retenční účinek, který zlepšuje chemoterapeutický efekt a snižuje toxicitu enkapsulovaného léčiva5. Liposomální transportéry mohou transportovat obrovské množství látek nebo částic. Vzhledem k tomu, že jsou liposomy schopny zvýšit efektivitu enkapsulovaných složek tím, že zvyšují stabilitu a chemicko-fyzikální biologickou dostupnost in vitro a in vivo, získávají velkou pozornost, co se týče enkapsulace antioxidantů, enzymů, vitamínů, částic, atd. Nicméně je stále třeba neustále hledat nové způsoby, jak překonat některá omezení liposomů jako je například přesné cílení v organizmu6.
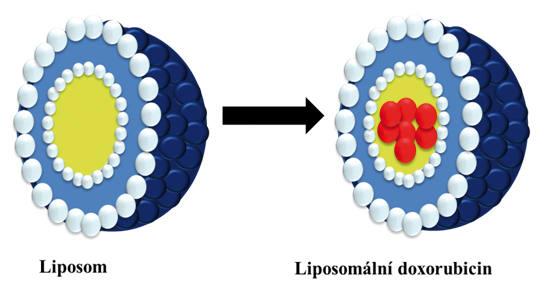
1. Kraft J. C., Freeling J. P., Wang Z. Y., Ho R. J. Y.: Journal of Pharmaceutical Sciences, 103, 29 (2014).
2. Saliba A. E., Vonkova I., Ceschia S., Findlay G. M., Maeda K., Tischer C., Deghou S., van Noort V., Bork P., Pawson T., Ellenberg J., Gavin A. C.: Nature Methods, 11, 47 (2014).
3. Nie Y., Ji L., Ding H., Xie L., Li L., He B., Wu Y., Gu Z. W.: Theranostics, 2, 1092 (2012).
4. Pottier A., Levy L., Meyre M., Germain M.: 44
5. Milla P., Dosio F., Cattel L.: Current Drug Metabolism, 13, 105 (2012).
6. Liu W. L., Ye A. Q., Liu W., Liu C. M., Singh H.: Agro Food Industry Hi-Tech, 24, 68 (2013).
7. Li L., ten Hagen T. L. M., Hossann M., Suss R., van Rhoon G. C., Eggermont A. M. M., Haemmerich D., Koning G. A.: Journal of Controlled Release, 168, 142 (2013).
8. Naik S. R., Desai S. K., Shah P. D., Wala S. M.: Recent patents on inflammation & allergy drug discovery, 7, 202 (2013).
9. Chen K. H., Di Sabatino M., Albertini B., Passerini N., Kett V. L.: European Journal of Pharmaceutical Sciences, 50, 312 (2013).
10. Lai F., Fadda A. M., Sinico C.: Expert Opinion on Drug Delivery, 10, 1003 (2013).
11. Smith H. J., Smith J. R.: 8
12. Manca M. L., Manconi M., Valenti D., Lai F., Loy G., Matricardi P., Fadda A. M.: Journal of Pharmaceutical Sciences, 101, 566 (2012).
13. Zhang X. W., Qi J. P., Lu Y., He W., Li X. Y., Wu W.: Nanomedicine-Nanotechnology Biology and Medicine, 10, 167 (2014).
14. Nguyen S., Hiorth M., Rykke M., Smistad G.: European Journal of Pharmaceutical Sciences, 50, 78 (2013).
15. de Barros A. L. B., Mota L. D., Soares D. C. F., de Souza C. M., Cassali G. D., Oliveira M. C., Cardoso V. N.: Journal of Biomedical Nanotechnology, 9, 1636 (2013).
16. Bragagni M., Mennini N., Maestrelli F., Cirri M., Mura P.: Drug Delivery, 19, 354 (2012).
17. Knudsen N. O., Ronholt S., Salte R. D., Jorgensen L., Thormann T., Basse L. H., Hansen J., Frokjaer S., Foged C.: European Journal of Pharmaceutics and Biopharmaceutics, 81, 532 (2012).
18. Perera R. H., Peiris P. M., Peteu S. F., Bayachou M.: Electroanalysis, 24, 37 (2012).
19. Huang Z., Dong L., Chen J. J., Gao F. B., Zhang Z. P., Chen J. N., Zhang J. F.: Life Sciences, 91, 1207 (2012).
20. Rengan A. K., Jagtap M., De A., Banerjee R., Srivastava R.: Nanoscale, 6, 916 (2014).
J.Met.Nano:
volume-1, issue-1
- Liposomální transportéry
- Moderní zobrazovací metody
- Apoferritin: Nanotransportér pro cílené dopravování léčiv
- Miniaturizované detekční systémy a jejich aplikace
- Detekce nukleových kyselin pomocí metody dot-blot
- Sledování role iontů kovů a metalothioneinu při vývoji prionových onemocnění
- Viry jako nanotransportéry léčiv
- MiRNA: Od biogeneze po využití v lékařství
- Shrnutí vzniku a mechanismu rezistence vůči těžkým kovům
- Prionové proteiny a jejich interakce s těžkými kovy
- Biosyntéza kvantových teček
- Zelená syntéza stříbrných a zlatých nanočástic pomocí extraktů z vyšších rostlin
- Vliv různych forem glutathionu na kulturu lactobacillus casei ssp. rhamnosus
 PDF
PDF