
MiRNA: Od biogeneze po využití v lékařství
Veronika Vlahová, Kristýna Šmerková, Markéta Vaculovičová, René Kizek
MicroRNA (miRNA) jsou malé endogenní molekuly RNA, které patří do skupiny nekódujících malých jaderných RNA. Velikost aktivních molekul miRNA se pohybuje zhruba okolo 22 nukleotidů. Význam těchto molekul spočívá v jejich schopnosti regulovat genovou expresi na posttranskripční úrovni1. Tento proces probíhá navázáním na 3´UTR konec cílové mediátorové RNA (mRNA). Cílová mRNA je poté buď degradována, nebo je pozastavena její translace. Jedna molekula miRNA je navíc schopna ovlivnit více molekul mRNA. Tímto způsobem je negativně regulována až třetina kódujících genů v genomu, což dělá z miRNA nejpočetnější skupinu regulátorů v buňce2. Její působení reguluje proliferaci buněk, jejich diferenciaci a apoptózu a všeobecně ovlivňuje množství důležitých biologických procesů3,4. Geny pro miRNA jsou rozprostřeny napříč celým genomem a jejich výskyt je značný, zabírají až 2 % celého genomu5. Jejich výskyt je velmi konzervativní, u velmi příbuzných druhů jsou zachovány téměř všechny miRNA a homology se vyskytují i u druhů velmi vzdálených6. V dnešních dnech je výzkumu miRNA věnována velká pozornost, a to hlavně díky jejímu vlivu na nádorovou transformaci buněk. Zhruba 50 % genů kódujících miRNA se nachází na fragilních částech chromozomů, které bývají pozměněny buď amplifikací, nebo delecí v průběhu karcinogeneze7. MiRNA se vyskytuje jak v pozici onkogenu, kdy exprese takovéto molekuly v tumorových buňkách narůstá, tak i v pozici tumor-supresorového genu, kdy dochází ke snížení nebo naprosté absenci exprese dané miRNA4,8. Z tohoto pohledu je jasné, že díky svým vlastnostem by miRNA mohly sloužit jako ideální diagnostické markery pro zjištění pravděpodobnosti recidivity onemocnění, její odpovědi na léčbu a pravděpodobnosti vzniku metastáz. Dalším pozitivem je její větší stabilita oproti mRNA, která byla běžně používána jako diagnostický marker. Velký potenciál má miRNA ve využití v protinádorové terapii. Díky procesu RNA interference, které se miRNA účastní, lze cíleně umlčet určité geny podporující např. proliferaci v nádorovém bujení. V dnešních dnech probíhá velké množství studií, které se zabývají otázkou cíleného transportu miRNA do buněk nádoru, a to aniž by došlo k aktivaci imunitní odpovědi. Dalším otázkou je, jak docílit tlumení pouze cílových mRNA9.
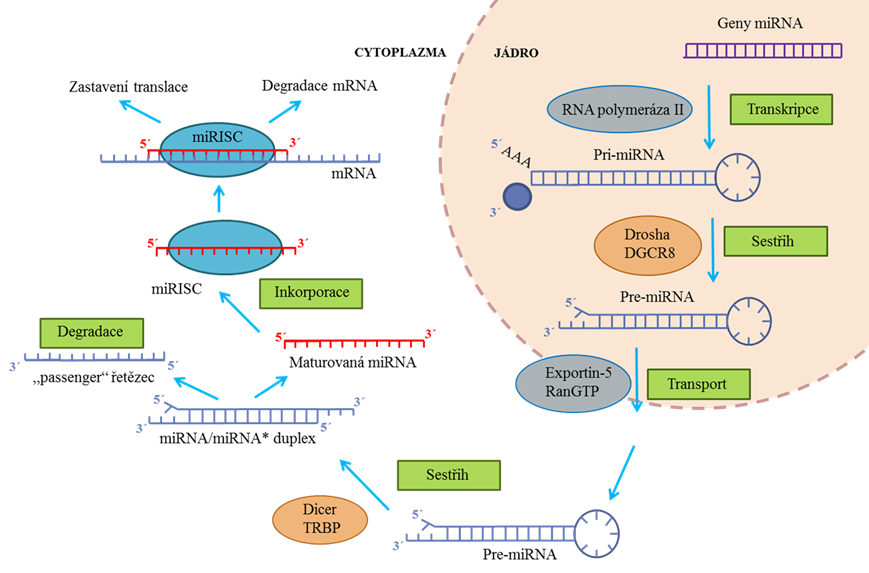
Obr. 1. Biogeneze miRNA. Prekurzor miRNA (pri-miRNA) je přepsán RNA polymerázou II. Pomocí komplexu Drosha/Pasha je pri-miRNA sestřihnuta na pre-miRNA, která je následně transportována do cytoplazmy pomocí komplexu Exportin 5. V cytoplazmě je pre-miRNA vyhledána komplexem Dicer, který sestřihne prekurzor na krátké duplexy RNA:RNA. Jeden řetězec z duplexu je degradován a druhý je navázán do komplexu RISC. Převzato a upraveno dle 27.
1. Ambros V.: Current Opinion in Genetics & Development, 21, 511 (2011).
2. Pasquinelli A. E., Ruvkun G.: Annual Review of Cell and Developmental Biology, 18, 495 (2002).
3. He L., Hannon G. J.: Nature Reviews Genetics, 5, 522 (2004).
4. Johnstone R. W., Ruefli A. A., Lowe S. W.: Cell, 108, 153 (2002).
5. Friedman R. C., Farh K. K. H., Burge C. B., Bartel D. P.: Genome Research, 19, 92 (2009).
6. Rhoades M. W., Reinhart B. J., Lim L. P., Burge C. B., Bartel B., Bartel D. P.: Cell, 110, 513 (2002).
7. Calin G. A., Sevignani C., Dan Dumitru C., Hyslop T., Noch E., Yendamuri S., Shimizu M., Rattan S., Bullrich F., Negrini M., Croce C. M.: Proceedings of the National Academy of Sciences of the United States of America, 101, 2999 (2004).
8. Kumar M. S., Lu J., Mercer K. L., Golub T. R., Jacks T.: Nature genetics, 39, 673 (2007).
9. Iorio M. V., Croce C. M.: EMBO molecular medicine, 4, 143 (2012).
10. Lee R. C., Feinbaum R. L., Ambros V.: Cell, 75, 843 (1993).
11. Reinhart B. J., Slack F. J., Basson M., Pasquinelli A. E., Bettinger J. C., Rougvie A. E., Horvitz H. R., Ruvkun G.: Nature, 403, 901 (2000).
12. Pasquinelli A. E., Reinhart B. J., Slack F., Martindale M. Q., Kuroda M. I., Maller B., Hayward D. C., Ball E. E., Degnan B., Muller P., Spring J., Srinivasan A., Fishman M., Finnerty J., Corbo J., Levine M., Leahy P., Davidson E., Ruvkun G.: Nature, 408, 86 (2000).
13. Rodriguez A., Griffiths-Jones S., Ashurst J. L., Bradley A.: Genome Research, 14, 1902 (2004).
14. Zimmerman A. L., Wu S. Y.: Cancer Letters, 300, 10 (2011).
15. Kim Y. K., Kim V. N.: Embo Journal, 26, 775 (2007).
16. Lee Y., Kim M., Han J. J., Yeom K. H., Lee S., Baek S. H., Kim V. N.: Embo Journal, 23, 4051 (2004).
17. Lee Y., Ahn C., Han J. J., Choi H., Kim J., Yim J., Lee J., Provost P., Radmark O., Kim S., Kim V. N.: Nature, 425, 415 (2003).
18. Bernstein E., Caudy A. A., Hammond S. M., Hannon G. J.: Nature, 409, 363 (2001).
19. Yi R., Qin Y., Macara I. G., Cullen B. R.: Genes & development, 17, 3011 (2003).
20. Gwizdek C., Ossareh-Nazari B., Brownawell A. M., Doglio A., Bertrand E., Macara I. G., Dargemont C.: Journal of Biological Chemistry, 278, 5505 (2003).
21. Gregory R. I., Yan K. P., Amuthan G., Chendrimada T., Doratotaj B., Cooch N., Shiekhattar R.: Nature, 432, 235 (2004).
22. Carthew R. W., Sontheimer E. J.: Cell, 136, 642 (2009).
23. Bhayani M. K., Calin G. A., Lai S. Y.: Mutation Research-Fundamental and Molecular Mechanisms of Mutagenesis, 731, 14 (2012).
24. Okamura K., Ishizuka A., Siomi H., Siomi M. C.: Genes & development, 18, 1655 (2004).
25. Lee I., Ajay S. S., Yook J. I., Kim H. S., Hong S. H., Kim N. H., Dhanasekaran S. M., Chinnaiyan A. M., Athey B. D.: Genome Research, 19, 1175 (2009).
26. Krol J., Loedige I., Filipowicz W.: Nature Reviews Genetics, 11, 597 (2010).
27. Winter J., Jung S., Keller S., Gregory R. I., Diederichs S.: Nature Cell Biology, 11, 228 (2009).
28. Su H., Trombly M. I., Chen J., Wang X. Z.: Genes & development, 23, 304 (2009).
29. Doench J. G., Sharp P. A.: Genes & development, 18, 504 (2004).
30. Calin G. A., Ferracin M., Cimmino A., Di Leva G., Shimizu M., Wojcik S. E., Iorio M. V., Visone R., Sever N. I., Fabbri M., Iuliano R., Palumbo T., Pichiorri F., Roldo C., Garzon R., Sevignani C., Rassenti L., Alder H., Volinia S., Liu C. G., Kipps T. J., Negrini M., Croce C. M.: New England Journal of Medicine, 353, 1793 (2005).
31. Li X. H., Zhang Y., Zhang Y. F., Ding J., Wu K. C., Fan D. M.: Gut, 59, 579 (2010).
32. Caramuta S., Egyhazi S., Rodolfo M., Witten D., Hansson J., Larsson C., Lui W. O.: Journal of Investigative Dermatology, 130, 2062 (2010).
33. Ji J. F., Shi J., Budhu A., Yu Z. P., Forgues M., Roessler S., Ambs S., Chen Y. D., Meltzer P. S., Croce C. M., Qin L. X., Man K., Lo C. M., Lee J., Ng I. O. L., Fan J., Tang Z. Y., Sun H. C., Wang X. W.: New England Journal of Medicine, 361, 1437 (2009).
34. Giovannetti E., Funel N., Peters G. J., Del Chiaro M., Erozenci L. A., Vasile E., Leon L. G., Pollina L. E., Groen A., Falcone A., Danesi R., Campani D., Verheul H. M., Boggi U.: Cancer Research, 70, 4528 (2010).
35. Meng F. Y., Henson R., Lang M., Wehbe H., Maheshwari S., Mendell J. T., Jiang J. M., Schmittgen T. D., Patel T.: Gastroenterology, 130, 2113 (2006).
36. Calin G. A., Cimmino A., Fabbri M., Ferracin M., Wojcik S. E., Shimizu M., Taccioli C., Zanesi N., Garzon R., Aqeilan R. I., Alder H., Volinia S., Rassenti L., Liu X., Liu C. G., Kipps T. J., Negrini M., Croce C. M.: Proceedings of the National Academy of Sciences of the United States of America, 105, 5166 (2008).
J.Met.Nano:
volume-1, issue-1
- Liposomální transportéry
- Moderní zobrazovací metody
- Apoferritin: Nanotransportér pro cílené dopravování léčiv
- Miniaturizované detekční systémy a jejich aplikace
- Detekce nukleových kyselin pomocí metody dot-blot
- Sledování role iontů kovů a metalothioneinu při vývoji prionových onemocnění
- Viry jako nanotransportéry léčiv
- MiRNA: Od biogeneze po využití v lékařství
- Shrnutí vzniku a mechanismu rezistence vůči těžkým kovům
- Prionové proteiny a jejich interakce s těžkými kovy
- Biosyntéza kvantových teček
- Zelená syntéza stříbrných a zlatých nanočástic pomocí extraktů z vyšších rostlin
- Vliv různych forem glutathionu na kulturu lactobacillus casei ssp. rhamnosus
 PDF
PDF