dusík
| asimilace dusíku | inkorporace dusíku | translokace dusíku | symptomy nedostatku a nadbytku dusíku | |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| asimilace nitrátového dusíku | asimilace amoniakálního dusíku | asimilace močoviny | fixace vzdušného dusíku |
Za normálních podmínek má nitrát pro výživu rostlin
největší význam. Kořeny ho přijímají aktivně ve směru
elektrochemického gradientu. V protikladu s příjmem je výdej NO3-
procesem pasivním. Nitrátový dusík je přijímán při pH
kyselejším. Při pH 6,8 se příjmem NO3- a
NH4+ v rostlinách může vyrovnat. Amonný
iont působí inhibičně na příjem nitrátové formy.
Dříve než může být nitrát metabolizován, je třeba
jej redukovat na NH3.
Tento proces zvaný redukce nitrátů sestává ze dvou etap, a to z
redukce NO3- na NO2- a z
další redukce NO2-
na NH3. Obecně uznávaný mechanismus asimilace
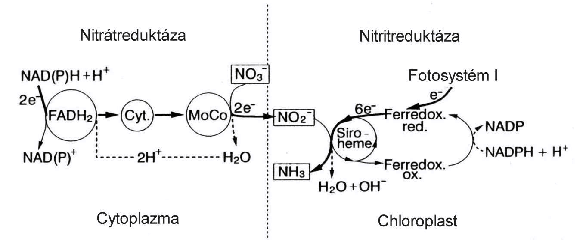
NO3- zelenými rostlinami na světle uvádí
obrázek. Schéma
asimilace nitrátů v buňkách listu (Beevers,
Hageman a Warner,
Kleinhofs cit. Marschner,
1995)
Enzymy, které se účastní tohoto procesu jsou nitrátreduktáza
a nitritreduktáza. Nitrátreduktáza sestává z flavinproteinu (FAD)
a Mo. Obě složky fungují jako nosiče elektronů v procesu přenosu
elektronů. Předpokládá se, že jedna složka přenáší
elektrony z NAD na flavin a obsahuje bílkovinu, druhá složka přenáší
elektrony přes Mo na nitrát. Je-li však Mo deficitní nebo
inaktivní (např. wolframem) enzym může přenášet elektrony z
NADH, ale nemůže redukovat nitrát. Důležitým znakem nitrátreduktázy
je to, že se jedná o indukovaný enzym a k jeho syntéze dochází
jen tehdy, je-li v cytoplazmě přítomen nitrát.
Druhým stupněm procesu asimilace nitrátů je redukce NO2-
na NH3:
NO2-
+ 6 H+
+ 6 e-
------->
NH3 +
H2O +
OH- Pro
tuto fázi je třeba silného redukčního činidla v zelených buňkách,
kterým je ferredoxin. Ferredoxin získává elektrony přímo z
fotosyntetického řetězu transportu elektronů.
Účinek nitrát- a nitritreduktázy může být vyjádřen
souhrně takto:
NO3-
+ 8 H+
+ 8 e-
------->
NH3 +
2 H2O +
OH-
Při této reakci je spotřebováno na redukci 1 molu NO3-
8 ekvivalentů elektronů H+. Reakce má alkalický účinek,
neboť je produkován jeden ekvivalent OH-.
Ionty OH- vzniklé při redukci nitrátů v
rostlinných buňkách mohou částečně zůstat v rostlině nebo být
převedeny do živného prostředí, a tak zvyšovat jeho pH. Při
jednostranné výživě NO3- je zvýšená
syntéza organických iontů, a tím je stimulován příjem kationtů,
a to především Ca2+ a K+.
Aktivitu nitrátreduktázového systému ovlivňuje řada
faktorů, z nichž světlo má velmi důležitou úlohu. Přenesením
rostlin ze světla do tmy je aktivita nitrátreduktázy potlačena i
tehdy, je-li NO3- přítomen v dostatečném
množství. Tento účinek spolu s poklesem redukční síly je
hlavní příčinou akumulace nitrátu při nižší intenzitě světla.
Akumulace nitrátu může často probíhat i jako důsledek nízké
intenzity osvětlení a vysokého hnojení nitráty.
Asimilaci nitrátu ovlivňuje i teplota. Bylo prokázáno, že
při teplotách kořenů kolem 30oC dochází k intezívnímu
příjmu NO3-, ale snižuje se aktivita nitrátreduktázy.
Vedle těchto faktorů je asimilace nitrátů ovlivněna i minerální
výživou, a to zejména Mo. Je-li Mo deficitní, dochází ke
kumulaci nitrátů a snížení aktivity nitrátreduktázy. Mn rovněž
ovlivňuje asimilaci nitrátu nepřímo, protože je nezbytnou složkou
fotosystému II, a tedy i toku elektronů z vody přes ferredoxin na
nitrátreduktázu.
Aktivita nitrátreduktázy se snižuje také vlivem
nedostatku Mg. Rovněž je nitrátová redukce závislá na
doprovodném kationtu. Tak KNO3 snižuje redukci nitrátů,
zatímco Ca a Na redukci zvyšují. Některé herbicidy (Diuron)
inhibují aktivitu nitritreduktázy.
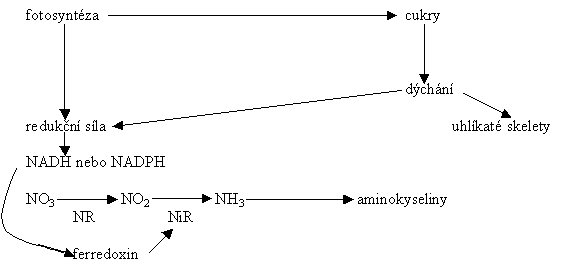
Zdroj redukční síly pro enzymy nitrátreduktázového systému
se v rostlinách obnovuje v energetickém metabolismu: při dýchání
vznikají dva typy pyridinových nukleotidů - NADH i NADPH, při
fotosyntéze se tvoří NADPH
a redukovaný ferredoxin. Při vysoké intenzitě osvětlení listu
se zvyšuje po přidání NO3- do
fotosyntetizujícího listu výdej O2. To potvrzuje přímé
spojení fotosynteticky vzniklé síry při redukci nitrátu (obrázek). Obecné schéma metabolismu spojené s redukcí nitrátů (podle
Bidwala 1979)
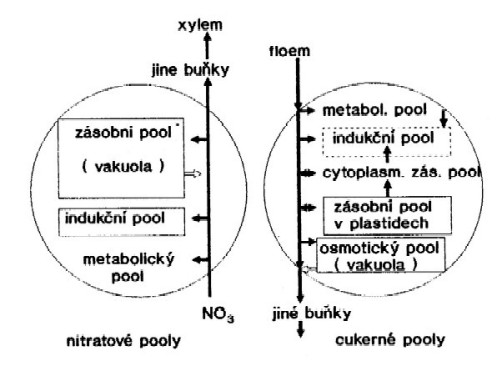
Rostlina přijatý nitrát ukládá do metabolického poolu,
kde NO3- podléhá redukci a dále do zásobního
poolu ve vakuole, v níž uložený nitrát není redukován a často
zvyšuje jeho obsah na nežádoucí úrověň. Vedle těchto poolů
(viz obrázek) existuje v buňce i malý krátkodobý pool indukční, který se přednostně doplňuje transportem nitrátů
zvenčí a stimuluje aktivitu nitrátreduktázového systému.
Podle toho, kde dochází k redukci nitrátů, můžeme rozlišovat
tři skupiny rostlin: a)
Rostliny s redukcí nitrátů v nadzemních částech, např.
brutnák, řepeň (Xanthium), kukuřice. V kořenovém systému těchto
rostlin je neměřitelná nitrátreduktáza. Xylémový roztok
obsahuje 95-99% dusíku ve formě NO3- iontů. b)
Rostliny s redukcí nitrátů v kořenech i v nadzemní části.
V obou rostlinných částech jsou hladiny nitrátreduktázy vysoké.
V xylému dochází k transportu NO3- iontů i
molekul organického dusíku. Tímto intermediárním
typem se vyznačuje většina rostlin. c)
Rostliny s asimilací NO3- v kořenech.
Převaha nitrátreduktázy je v kořenech, takže v xylému se
pohybuje převážně organický dusík. Asimilací toho typu se
vyznačují některé dřeviny.
Pro redukci nitrátu všeobecně platí, pokud NO3-
je příjímán v nízkých kvantech, tak je jeho značná část
redukovaná v kořenech. Zvyšující se příjem nitrátu (luxusní
výživa) omezuje kapacitu redukce nitrátu v kořenech a NO3-
je ve míře transportován do nadzemních částí.
Schématické znázornění nitrátových a cukerných poolů z
hlediska indukce a syntézy nitrátreduktázy (Sahulka 1980) Obdélníky s plnými čarami ...
kompartmenty ohraničené semipermeabilní membránou.
Šipky s přerušovanou čarou ... transport omezen.
Kumulace nitrátů představuje v rostlině rozdíl mezi příjmem
a jeho redukcí. Určité rostliny se vyznačují velkým příjmem
nitrátů a neefektivní redukční schopností. Tyto rostliny mají
tendenci kumulovat nitráty a řadíme k nim: špenát, celer,
zeleninovou řepu, ředkvičku, rychlený salát aj.
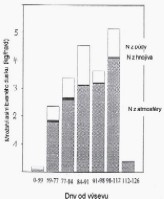
Obsah Nmin v půdě a koncentrace NaNO3 v čerstvé
hmotě salátu (Richter 1990)
Při výživě rostlin vysokými dávkami dusíku dochází v
půdě činností nitrifikačních bakterií k jejich přeměně na
nitráty. Vysoká koncentrace nitrátů v živném prostředí nebo
použití ledků k hnojení na list udržuje vysoký obsah nitrátů
v rostlinách, který zvláště u zelenin a krmných plodin může
vést ke zhošení zdravotního stavu. Volf (1981) uvádí, že
toxická dávka dusičnanů pro dospělého člověka je 6 g a pro
kojence 100 mg. Toxicita nitrátů se může projevovat
methemoglobinemií a vedle toho nitráty mohou být v zažívacím
traktu přeměňovány na karcinogenní nitrosaminy. Pro odstranění
tohoto nebezpečí je nutné používat dusíkatá hnojiva v únosných
dávkách, omezovat nitrifikaci používání inhibitorů jejich činností
a kontrolovat obsah nitrátů v zeleninách a krmivech. Limity pro obsah nitrátů v zeleninách
(Vyhláška Ministerstva zdravotnictví č. 53/2002)
NPM – nejvyšší přípustné
množství, při jehož překročení je potravina a potravinová
surovina vyloučena z oběhu PM – přípustné množství Příklady
koncentrací dusičnanů v závislosti na termínu sklizně (mg
NO3/kg)
Příklady
koncentrací dusičnanů v různých částech rostlin (mg NO3/kg
čerstvé hmoty)
Příklady
koncentrací dusičnanů v hlávkovém salátu a rajčatech (mg
NO3/kg čerstvé hmoty) v závislosti na původu
Asimilace amoniakálního dusíku
Příjem kationtové formy dusíku není dosud plně objasněn.
Názory se liší v tom, jestli je dusík příjímán jako NH4+
kationt nebo ve formě neutrální molekuly NH3. Předpokládá
se, že NH3 je přijímán přednostně, zvláště při
vyšším pH, tj. v neutrálním a zásaditém prostředí. Amonný
iont působí inhibičně na příjem nitrátové formy N. Inhibice
není zdůvodňována zvyšující se koncentrací NH4+
v roztoku, ale je i důsledkem saturace specifických míst jeho příjmu.
Vznikem aminokyselin a iontů H+ jako produktu asimilace
NH4+ se v cytoplazmě zvyšuje acidita, která
může neutralizací transmembránového gradientu pH v kořenových
buňkách omezit přenos iontů NO3- přes
membránu do buňky.
Při výživě rostlin amoniakálním dusíkem je celkově nižší
příjem většiny iontů, ale zvláště kationtů (Ca2+,
Mg2+, K+) a organických aniontů.
Z energetického hlediska je amoniakální dusík výhodným
zdrojem pro rostliny, protože může být přímo zapojen do
metabolismu bez dalších požadavků na energii. Tuto „výhodu“
můžeme pozorovat jen při nízkých koncentracích NH4+
dusíku v živném prostředí.
Asimilace NH4+ předpokládá pouze odštěpení
H+ z kationtu:
NH4+
------->
NH3 +
H+
Vzniklé H+ ionty jsou obvykle vylučovány do vnějšího
prostředí, a tak snižují pH (okyselení).
Z chemických analýz vyplývá, že deprese růstu při NH4+
výživě není způsobená zvýšenou kumulací dusíkatých iontů,
ale vyčerpáním sacharidů. Amoniak potom není rostlina schopná
utilizovat, a tak se zvyšuje alkalita buněk. Volný amoniak v buňce
blokuje fotosyntetickou fosforylaci, omezuje dýchací procesy, snižuje
oxidoredukci (NADH -->
NAD) atp.
NH3 může být pro rostlinu toxický již při nízkých
koncentracích. Toxicita je závislá i na pH živného prostředí.
Zásadité pH živného roztoku toxicitu NH4+
zvyšuje a kořeny mohou být již při nižší koncentraci tohoto
iontu poškozeny.
Močovina může být přijímána rostlinami po jejím předchozím
rozkladu v půdě ureázou nebo ve formě celých molekul (zvláště
při foliární výživě). V přirozených půdních podmínkách
je močovina přijímána rostlinami po jejím rozkladu na NH4+
nebo dále po mikrobiální přeměně na NO3-.
Rostliny jsou schopny přijímat také močovinu ve formě
celých molekul a v kořenech i dalších rostlinných tkáních ji
ureázou přeměňovat na amoniak. Reakce probíhá podle rovnice:
Tuto
schopnost však nevykazují všechny rostliny. Aktivita ureázy se s
postupujícími vývojovými fázemi snižuje.
Vedle tohoto enzymatického rozkladu močoviny v rostlině předpokládá
řada autorů včlenění N močoviny do N metabolismu přímo. Schématicky
je možné reakci znázornit takto:
CO(NH2)2
------>
karbamidová kyselina
-------> aminokyseliny
U pšenice, žita, ječmene, ovsa a kukuřice byla v rostlinách
močovina nalezena v době vzcházení. Syntetická močovina může
v rostlině plnit funkci amidů a v této formě ji kořenový systém
může předávat do nadzemních orgánů. Asimilace močoviny je
aktivní metabolický proces, který je pro rostliny zdrojem nejen
N, ale i uhlíku. Potvrdily to práce se značenou močovinou u rýže
a pšenice.
Na základě nádobových pokusů bylo zjištěno, že v
porovnání s ostatními formami dusíku projevovala močovina určitou
růstovou depresi, která byla v literatuře nazvána „fytotoxicita
močoviny“. Její příčiny jsou ve vysokém obsahu biuretu, v účinku
samotné močoviny nebo meziproduktech přeměny v půdě (NH4OCN
nebo NH3), v rostlině.
Biuret (H2N-CO-NH-CO-NH2) je vždy přítomen
v močovině a při hnojení je nutné znát jeho obsah v hnojivu.
Symptomy poškození rostlin biuretem jsou popisovány jako mezižeberní
žloutnutí listů, zasychání listů od špiček, deformace listů,
brzdění prorůstání prvního listu z koleoptile u obilovin. Toto
onemocnění pojmenovali Babička, Zalabák (1966) hyponastií, a
bylo prokázáno na základě pokusů s biuretem. Pokusy prováděné
ve vodních kulturách potvrdily při koncentraci 50 ppm jeho toxický
účinek.
Toxicita biuretu se vysvětluje vlivem na Krebsův cyklus,
kde se blokují centra fixující amoniak, a tím se nepřímo ovlivňuje
syntéza bílkovin v listech. Další příčinou toxického působení
může být nadměrné množství amoniaku, který vzniká vysokou
ureázovou aktivitou některých rostlin (vikvovité). Amoniak
rostlina není schopna zabudovat do organických sloučenin z důvodu
nedostatku sacharidů. Proto se nedoporučuje jednorázově
aplikovat vyšší dávky dusíku ve formě močoviny než 100kg.ha-1,
aby nedošlo k poškození zvláště malosemenných rostlin. Fixace vzdušného dusíku rostlinami
Inertní vzdušný dusík dovedou využívat diazotrofní
mikroorganismy. Tyto organismy poutající N2 představují
ekologicky nejvýznamnější úroveň autotrofie vzhledem k dusíku.
Některé z nich žijí volně v půdě a vodě, jiné jako
symbionty.
Nesymbiotickou fixaci dusíku provádí řada půdních
bakterií (Clostridium pasteurianum, Azotobacter chroococcum aj.),
vodní bakterie, sinice aj.).
Symbiotická fixace dusíku využívá energii získanou
fotosyntézou u rostlin k přeměně N2 na NH3.
Na této přeměně se zúčastňuje v převážné míře rod
Rhizobium. Symbionti poutající N2 si opatřují potřebné
sacharidy v buňkách autotrofních rostlin. Na každý gram dusíku
obsaženého v aminokyselinách a amidech se v době největší
syntetické aktivity hostitelské rostliny v hlízkových bakteriích
spotřebují 4g uhlíku obsaženého v sacharidech. Proto množství
N2 poutaného symbionty velmi závisí na fotosyntéze
hostitelské rostliny.
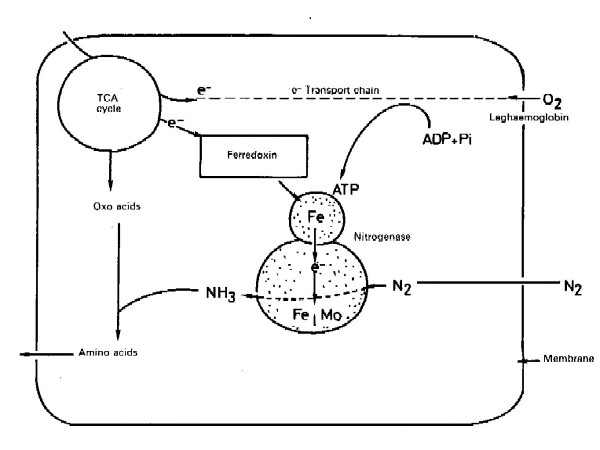
Schéma fixace vzdušného dusíku N2 (podle Mengela,
Kirkbyho 1978)
Na obrázku je uvedeno schéma procesu fixace. Centrální význam
má nitrogenáza, sestávající ze dvou bílkovinných komplexů -
Fe a Mo. Celý systém je obalen membránou a je lokalizován v buňkách
kořenové pokožky rhizobia. Při fixaci N2 je zapotřebí
elektronů a ATP. Elektrony jsou dodávány přes ferredoxin na
nitrogenázu, která je místem redukce N2. Cyklus
trikarboxylové kyseliny tohoto systému dodává oxokyseliny (oxoglutarát
a oxalacetát), které reagují s NH3 za vzniku
aminokyselin (cestou redukční aminace). Vzniklé aminokyseliny
mohou být využity při syntéze bílkovin v hlízkách a kromě
toho značná část aminokyselin je transportována do hostitelské
rostliny, kde je začleněna do metabolismu dusíku. Bakteroid
obsahuje leghemoglobin, který funguje jako nosič O2 v
řetězci transportu elektronů.
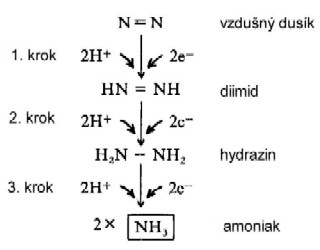
Redukce N2 probíhá velmi rychle. Předpokládá
se, že má 3 stupně: diimid, hydrazin, NH3.
Místem redukce N2 je Fe - Mo bílkovinný
komplex. Existuje hypotéza, že Mg tvoří můstek mezi Fe-bílkovinným
komplexem a ATP. K redukci l molekuly N2 je zapotřebí
asi 4-5 molekul ATP.
Rhizobia pro svou činnost potřebují dále Cu a Co. Kobalt je
esenciální složkou propionátového cyklu, který zřejmě řídí
syntézu leghemoglobinu.
Množství redukovaného N2 celosvětově činí v
průměru 17,2.107 tun ročně, což je přibližně 2,5x
více než je množství dusíku vyrobeného chemickým průmyslem,
kde se spotřebuje na 1kg vyrobeného N asi 8 373 kJ. Výkonnost
fixace N luštěnin na zrno
Výkon fixace
N u pícnin
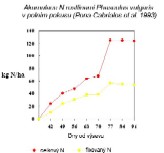
Původ N uloženého
v Lupině bílé (Vlčí bob bílý) v závislosti na
aplikaci cukru a hnojení N v době květu
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
autor textu: Prof. Ing. Rostislav Richter, DrSc. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Poslední aktualizace: 23.01.2004 08:40
Ústav agrochemie a výživy rostlin, MZLU v Brně, Zemědělská 1, 613 00 Brno