půdní reakce
|
| půdní reakce | vápnění půd | |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Půdní reakce je dána přítomností a aktivitou vodíkových
iontů, které se ve vodných roztocích spojují s molekulou vody a
tvoří s ní anionty H3O+ (hydroxoniové nebo
oxoniové ionty). V půdním roztoku rozpuštěné kyseliny a
koloidní acidoidy uvolňují vodíkové ionty (disociace); rozpuštěné
zásady a bazoidy se s nimi slučují (asociace). K
okyselení půdy dochází:
K
alkalické reakci půdy přispívá hlavně:
Vzhledem k tomu, že půda je třífázový systém, rozeznáváme
u ní dvě základní formy kyselosti: 1.
Kyselost aktivní (aktuální), 2.
Kyselost potencionální, která se dělí na:
a) výměnnou,
b) hydrolytickou.
Aktivní kyselost je dána koncentrací iontů H+ v půdním
roztoku. Je tvořena minerálními a organickými kyselinami půdního
roztoku, hydrolyticky kyselými hnojivy a kyselými spady. Má
bezprostřední vliv na příjem živin rostlinami. Stanovuje se ve
výluhu půdy vodou.
Výměnná kyselost je způsobená adsorbovanými H+ a Al3+
(příp. Fe) ionty, které se vyměňují za bazické ionty roztokem
neutrální soli KCl (CaCl2) .
[VSK]-H +
KCl
----------> [VSK]-K +
HCl
AlCl3 +
3 H2O
----------> Al(OH)3 +
3 HCl
Výměnné kyselosti se využívá ke stanovení potřeby vápnění.
Pro potřeby KÚP se půdy rozdělují v závislosti na půdním
druhu na silně kyselé, kyselé, slabě kyselé, neutrální a zásadité.
Hydrolytická kyselost. Extrakcí půdy roztokem neutrální soli (KCl)
se všechny ionty H+ nepodaří z VSK vytěsnit. K vytěsnění
pevněji vázaných H+ je proto používáno hydrolyticky
alkalických solí octanu sodného nebo vápenatého. Tyto sloučeniny
se ve vodním roztoku hydrolyticky štěpí za vzniku slabé
kyseliny a silně disociované zásady:
CH3COONa +
H2O ---------->
CH3COOH +
Na+ +
OH- Vzniklý
roztok vykazuje proto alkalickou reakci (pH = 8,5), která je hlavní
příčinou dokonalejšího vytěsnění iontů H+ vázaných
v sorpčním komplexu půdy:
[VSK]-H +
Na+ +
OH- +
CH3COOH ---------->
[VSK]-Na +
H2O + CH3COOH
Čím více iontů H+ je z VSK ionty Na+
vytěsněno, tím více iontů OH- je neutralizováno na
H2O, a tím více se v roztoku projeví kyselost CH3COOH.
Její koncentrace se stanoví titrací louhem na vhodný indikátor
a vyjádří se v mekv na 1kg půdy. V některých zemích se hodnot
hydrolytické kyselosti využívá ke stanovení potřeby vápnění
půd a k maximální sorpční kapacitě půd.
Půdní reakce má výrazný vliv na úrodnost půdy. V silně
kyselých půdách se nedaří některým užitečným bakteriím
velmi důležitým pro optimální průběh biochemických reakcí v
půdě (Rhizobia, Azotobacter chroococum, nitrifikační bakterie
aj.). Dochází ke vzniku příznivých podmínek pro činnost plísní,
hub apod., které jsou pro úrodnost půdy méně vhodné.
Mineralizační procesy jsou v kyselých podmínkách vesměs
zpomaleny a syntetické procesy vedou ke tvorbě méně kvalitních
humusových látek (fulvokyselin). Vysoká kyselost půdy nepříznivě
ovlivňuje efektivnost využití některých hnojiv. V tomto prostředí
je také aktivován hliník a řada těžkých kovů, jejichž přebytek
rostlinám škodí a vede k jejich začlenění do potravního řetězce.
Účinným opatřením k odstranění půdní kyselosti je pravidelné
vápnění.
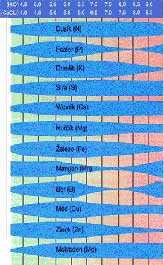
Půdní reakce má bezprostřední vztah k příjmu živin. Závislost
přístupnosti živin na reakci živného prostředí uvádí obrázek. Vliv
pH na příjem živin (Ivanič et al. 1984)
Jednotlivé druhy polních plodin mají také na reakci půdy
rozdílné požadavky (tabulka).
Nároky vybraných plodin na půdní reakci (pH/KCl)
(Baier-Baierová 1985)
Obecně můžeme shrnout, že polní plodiny bramborářského
a horského výrobního typu i trvalé travní porosty vyžadují pH
kyselejší, zatímco plodiny řepařského a kukuřičného výrobního
typu spíše pH neutrální. Ze zelenin převládá pH neutrální až
zásadité u košťálovin a plodových zelenin.
Kyselá
půdní reakce působí nepříznivě na růst většiny plodin. K okyselení
půdy dochází:
V kyselých půdách se nedaří užitečným půdním baktériím (hlízkové baktérie, nitrifikační baktérie aj.), intenzívněji se rozšiřují houby a plísně, tvoří se více fulvokyselin na úkor kvalitních humínových kyselin, dochází k rozpadu (degradaci) sorpčního komplexu, je snižován příjem většiny živin, zvyšuje se obsah hliníku, železa a těžkých kovů (kadmia, olova aj.).
Zásaditá (alkalická)
půdní reakce působí rovněž nepříznivě na růst rostlin. K
alkalitě půd vede:
Zvýšená alkalita půdy způsobuje peptizaci půdních koloidů (tvorba škraloupu), omezuje příjem některých živin (bór, zinek, měď, železo a většiny těžkých kovů).
Půdní reakci mohou výrazně ovlivňovat průmyslová
hnojiva, u kterých rozlišujeme:
Půdní kyselost můžeme negativně ovlivnit jednostranným používáním fyziologicky kyselých hnojiv. Fyziologická reakce hnojiva je způsobena vlivem rostliny v závislosti na selektivním příjmu aniontu nebo kationtu kořeny rostlin. Jsou-li přednostně z hnojiva přijímány kationty a půdy mají malý obsah vápníku, jsou hnojiva fyziologicky kyselá (síran amonný, draselná sůl, síran draselný aj.), při intenzívním příjmu aniontů jsou hnojiva fyziologicky zásaditá (ledek vápenatý, dusíkaté vápno, vápenec aj.) nebo pokud přijímají stejným podílem anionty i kationty, jsou fyziologicky neutrální (tab. 4).
Vliv
průmyslových hnojiv na pH půdy
Ekvivalent kyselosti - vyjadřuje množství CaO (CaCO3)
potřebného k neutralizaci vzniklé kyselé reakce po aplikaci
hnojiva.
Ekvivalent zásaditosti + udává množství alkalicky působícího
CaO, které hnojivo dodává do půdy.
Vliv hnojiva na pH půdy lze určit pomocí ekvivalentu kyselosti (E
v kg CaO . ha-1): E (kg
CaO.ha-1) = (1,0.CaO + 1,4.MgO + 0,6.K2O
+ 0,9.Na2O) -
n u dusíku - orná půda = 0,7
- TTP = 0,8
Ekvivalenty kyselosti nebo zásaditosti poskytují informace
o působení hnojiva a jsou důležitým ukazatelem pro vápnění. Příklad: na
1 ha dodáme: 200
kg síranu amonného (40 kg N, 143,8 kg SO4) 100
kg draselné soli 60% (60 kg K2O, 48 kg Cl) E
(kg CaO) = (0,6 x 60 kg K2O) - (0,7 x 143,8 kg SO4 + 0,8 x 48 kg Cl
+ 0,5 x 40 kg N) = 123 kg CaO Pro
vyrovnání kyselosti způsobené 200 kg síranu amonného a 100 kg
60% draselné soli je nutno dodat 123 kg CaO.ha-1. Vápnění
půd
Úpravu půdní reakce na optimální hodnotu pH u minerálních půd provádíme vápněním. Pro stanovení dávky vápnění vycházíme z hodnoty výměnné půdní kyselosti (pH/KCl nebo pH/CaCl2) a zrnitostního složení půdy. Doporučené roční normativy uvádí tab.6. Použitím ročních normativů nedosáhneme často na všech stanovištích požadované optimální hodnoty pH, jak jsou uvedeny v tab.2 a to ani s připočtením dávky CaO podle ztrát vápníku, způsobených jeho vymýváním z půdy, odběrem plodinami, působením minerálních hnojiv a vlivem atmosférického spadu (tab.5).Zpřesnění lze dosáhnout s přihlédnutím k mocnosti( hloubce) ornice. Dávky uvedené v tab.6 se vztahují k mocnosti ornice 0,2 m. Je-li ornice hlubší, zvýší se dávka o 50 %. Při mělčí vrstvě ( např. 0,15 m) se sníží o 25 % atp. Roční ztráty vápníku určující
dávku udržovacího vápnění
Roční normativy dávek vápenatých
hnojiv v tunách t CaO.ha-1
V současné době došlo k silnému poklesu ve spotřebě vápenatých hnojiv a začíná se pozvolna zvyšovat podíl kyselejších půd. Proto je třeba přednostně vápnit pozemky, které se nejvíce vzdalují od optimálního pH, a na nichž budou pěstovány plodiny dobře reagující na vápnění (vojtěška, cukrovka, řepka, hořčice, zelí, sója, kukuřice, ječmen, pšenice, jetel, bob, hrách, krmná kapusta). Vápnění představuje jedno ze základních opatření v péči o půdní úrodnost. Dodaný vápník působí a upravuje:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
autor textu: Prof. Ing. Rostislav Richter, DrSc. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Poslední aktualizace: 28.01.2004 13:16
Ústav agrochemie a výživy rostlin, MZLU v Brně, Zemědělská 1, 613 00 Brno