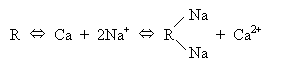sorpční schopnost půdy
|
| výměnná sorpce kationtů | nevýměnná sorpce kationtů (fixace) | výměnná sorpce aniontů |
Její podstatou jsou elektrostatické síly, resp. vzájemná
neutralizace opačně nabitých částic. Na jedné straně jsou to
koloidní částice minerálního i organického podílu pevné fáze
půdy, na druhé straně je to půdní roztok, obsahující
ionty živin. Na rozhraní obou těchto fází vznikají
povrchové náboje a v důsledku toho i různé adsorpční jevy. Výměna
iontů mezi pevnou a kapalnou fází půdy je reverzibilní proces.
Soubor všech půdních koloidů se běžně označuje jako výměnný
sorpční komplex, který je tvořen půdními koloidy (do 0,001
mm), vyznačujícími se některými vlastnostmi shodnými s koloidy.
Půdní koloidy představují látky organické (humusové), minerální,
jílové minerály, oxidy Al a Fe a organominerální.
V půdách se vyskytují:
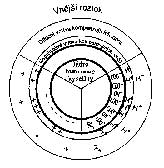
Zjednodušené schéma koloidní organominerální micely uvádí
obrázek vpravo nahoře. Ve středu je jádro, které se svým
povrchem tvoří koloidní granuli. Na jejím povrchu je nabíjecí
vrstva, která určuje náboj granule (záporně nabité). Pro
zachování neutrality micely musí být k dispozici opačně nabité
ionty, které tvoří vrstvu kompenzujících iontů (kationtů).
Obě vrstvy tvoří elektrickou dvojvrstvu, která určuje povahu
elektrokinetického potenciálu. Vrstva kompenzujících iontů se dělí
na dvě části: na nepohyblivou vrstvu, která těsně přiléhá k
nabíjecí vrstvě (Sternerova vrstva) a na difúzní vrstvu, nacházející
se směrem k vnějšímu roztoku (Goyuova vrstva).
K výměnné sorpci kationtů dochází mezi půdním
roztokem a iontovou dvojvrstvou fázového rozhraní minerálních a
organických půdních koloidů vyvolaných difúzními ději. Její
intenzita závisí na vlastnostech sorbentů, hodnotě pH půdního
roztoku, koncentraci iontů a iontové síle, teplotě půdy, stupně
hydratace iontů aj. Z minerálního podílu půdy jsou to hlavně jílové
minerály, které se vyznačují touto schopností.
U kaolinitů jsou těžištěm výměnné sorpce kationtů
prakticky pouze volné valence kyslíku v místech přerušených
vrstev mezi sousedními tetraedry. Podobný způsob výměnné
sorpce kationtů je znám u většiny jílových minerálů.
U jílových minerálů typu montmorillonitu k vzniku záporného
náboje dochází: a)
izomorfní záměnou pozitivního Si4+ v silikátových
tetraedrech Al3+. Tím vznikne jeden volný záporný náboj,
který může být kompenzován kladným nábojem.
(SiO2)n
[(SiO2)m-Si4+ + Al3+]-
neutrální stav
struktura s jedním záporným nábojem b)
izomorfní záměnou iontů Al3+ ve vnitřní
oktaedrické vrstvě jílového minerálu pozitivně nabitými
dvojmocnými ionty Mg2+, Fe2+. Tato záměna
je typická pro montmorillonit.
[Al(OH)6]n {[Al(OH)6]n-Al3+
+ Mg2+}-
U těchto jílových
minerálů spolu s vodou pronikají do lamel ve vodě rozpuštěné
prvky (hydratované ionty), které se mohou vyměňovat za ionty
nacházející se v těchto prostorách. Tím dochází k intramicelární
sorpci živin i vnitřním povrchu jílových minerálů. c)
K vzniku záporných nábojů dochází i oddisociováním H+
zejména na okrajích a hranách krystalové mřížky (extramicelární
sorpce živin). V kyselých půdách (pH 5) k této sorpci nedochází,
protože H+ ionty nedisociují. d)
Záporný náboj vzniká odštěpením H+ z
fenolických, hydroxylových nebo karboxylových skupin organických
koloidů (huminové kyseliny).
Výměna kationtů přímo závisí na zastoupení koloidně
disperzních částic v půdě. Při výměně kationtů mezi půdním
roztokem a sorpčním půdním komplexem dochází za určitých
podmínek k rovnovážnému stavu. Změnou složení a koncentrace
prvků v půdním roztoku (vlivem hnojení, závlahy, mineralizací
organických hnojiv aj.) se rovnovážný stav narušuje. K obnovení
rovnovážného stavu přecházejí kationty z půdního roztoku do
sorpčního komplexu a opačně.
Výměna kationtů probíhá mezi jednovalentními a vícevalentními
ionty. K výměně kationtů dochází o stejné valenci (K+
- NH4+, Ca2+ - Mg2+)
nebo o různé valenci (Ca2+ - K+, Mg2+
- NH4+ aj.). Jestliže výměna probíhá mezi kationty o stejné valenci platí, že při dosažení rovnovážného stavu je vzájemný poměr adsorbovaných kationtů proporcionální jejich vzájemnému poměru v půdním roztoku a nezávisí na jejich koncentraci. Pokud dochází k výměně mezi kationty o různé valenci, jsou vztahy složitější a uplatňuje se výrazně iontová síla půdního roztoku. Výměna kationtů se řídí zákonem o působení hmoty, který lze vyjádřit pro výměnu:
Dále platí zásada, že intenzívněji jsou adsorbovány
ionty o vyšší valenci. Intenzita adsorbce kationtů o
stejné valenci závisí na jejich hydratačním obalu. Hydratační
obal je tím větší, čím menší je velikost iontů. Poloměry
některých iontů v mm
-
nejsou uvedeny v literatuře
Ionty s malým poloměrem přitahují velké množství dipólů
vody a mají tedy větší obal než ionty s velkými poloměry.
Proto hydratované ionty stejného mocenství jsou slaběji adsorbovány
(lyotropní řada):
Li+ <
Na+ <
K+ £
NH4+ ;
Mg2+ <
Ca2+ ;
Al3+ <
Fe3+
Hydratovanější ionty jsou lépe z výměnného sorpčního
komplexu vytěsněny, poněvadž jsou slaběji poutány. Výjimkou
je H+, který s H2O tvoří H3O+
o poloměru 0,135, proto je H+ adsorbován silněji než
většina jednomocných a dvojmocných kationtů.
Uvedené poznatky mají značný praktický význam. Při
dostatku vláhy v půdě (jaro, podzim) půda intenzivněji
adsorbuje dvojmocné kationty a adsorbce jednomocných kationtů se
snižuje. Do půdního roztoku přechází K+, NH4+,
Na+. Při vysychání půdy je tomu naopak. Nevýměnná
sorpce kationtů (fixace)
Ionty některých živin (NH4+, K+)
mohou být v půdě sorbovány pevněji než-li výměnnou sorpcí,
tzv. fixací. Je to ireverzibilní (nevratná) adsorpce kationtů některými
složkami půdy. Fixaci podléhají ty ionty, které se vejdou (za
sucha bez hydratačního obalu) do šestiúhelníkové dutiny mezi
atomy kyslíku sousedící se šesti Si-tetraedry v krystalové mřížce
vrstevných alumosilikátů a dále do mezivrstevných prostorů. Průměr
dutiny je 0,28 nm. Z kationtů to jsou K+, NH4+,
H3O+, Rb+, Ba2+, jejichž
průměry jsou mezi 0,266-0,296 nm. Hydratace zvětšuje rozměr
iontů (tabulka výše) a proto při vysychání bývá fixace větší.
Z půdního roztoku jsou nejvíce fixovány NH4+
a K+ ionty. Schopností fixovat kationty se vyznačují
hlavně illity, montmorillonity, vermiculit. Fixované kationty
mohou být rostlinami využívny. Zvláště fixovaný NH4+
z hnojiv je opět během vegetace postupně rostlinami využíván
(až do 75-80%).
V našich půdách probíhá v omezené míře. Je umožněna
hlavně vznikem kladných nábojů na organických i minerálních
koloidech v kyselém prostředí, kdy dochází k disociaci některých
funkčních skupin (např. OH-) a vzniklý kladný náboj
koloidu může být neutralizovn záporným nábojem iontu z půdního
roztoku (např. H2PO4-).
Rovněž některé amorfní gely a sraženiny v půdě
vykazují určitou schopnost výměnné sorpce aniontů.
[Al(OH)3]n
Û {[Al(OH)3]n-OH}+
neutrální struktura
struktura s jedním kladným nábojem
schopným vázat záporný náboj aniontu
Vzhledem k relativně nízkému obsahu kladných nábojů v půdě
je schopnost výměnné sorpce aniontů zvláště v neutrálních půdách
malá a pohybuje se v rozpětí 1-5%. |
||||||||||||||||||||||||||||||||||||||
|
autor textu: Prof. Ing. Rostislav Richter, DrSc. |
||||||||||||||||||||||||||||||||||||||
Poslední aktualizace: 28.01.2004 08:45
 Velikost hydratovaných kationtů |
 Fixace draslíku v illitu |
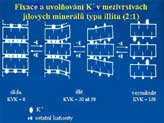 Fixace a uvolňování draslíku |
|
|
|
|
Ústav agrochemie a výživy rostlin, MZLU v Brně, Zemědělská 1, 613 00 Brno