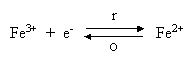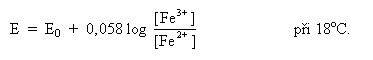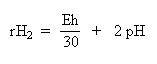redukčně oxidační procesy v půdě
|
|
||
|
Oxidace a redukce jsou součástí komplexních chemických dějů v půdách a doprovázejí biochemické pochody při zajišťování energie půdními organismy. Při oxidaci ztrácí oxidovaná látka elektrony, při redukci je získává. Každá oxidace je provázena současně redukcí. Nejvýznamnější redukčně oxidační systémy v půdách představují ionty nebo sloučeniny dvoj- a trojmocného železa:
V rovnici e- - značí elektron, r - redukci, o -
oxidaci.
Rovnováha se ustavuje podle toho, zda v systému převažuje
redukce nebo oxidace. Výsledkem je potenciál, který můžeme změřit
v systému oxidačně redukční elektrodou (redox potenciál), pro
který platí vztah: Symbol
E označuje potenciál v libovolné rovnováze, E0 je
normální potenciál redox systému, měřený oxidačně redukční
elektrodou s jednotkovou koncentrací [Fe3+], [Fe2+]
i [H+] proti normální vodíkové elektrodě.
Měřítkem převahy redukce či oxidace je redox potenciál
(Eh). Hodnoty Eh se mění podle druhu a typu půdy i podle ročního
období, nejčastěji od 200mV při silně redukčních podmínkách
do 750 mV při oxidačních podmínkách. Eh závisí hlavně na
provlhlosti nebo provzdušnění půdy, její struktuře, na přítomnosti
rozkladu schopné organické hmoty. Podzolové půdy s kyselou reakcí
mají Eh 600-750, černozemně neutrální 450-600. K významným
redukčním pochodům v půdě patří hnití, rašelinění,
denitrifikace, desulfurikace; k oxidačním procesům náleží v půdě
mineralizace, nitrogeneze, nitrifikace, oxidace sulfidů, elementární
síry, Fe2+ a Mn2+.
Jelikož hodnota Eh závisí i od pH půdního roztoku, používá
se k dosažení srovnatelných hodnot Eh při různém pH ukazatele
rH2. Ten vypočteme
V dobře aerovaných půdách činí hodnoty rH2
28-34, v neprovzdušněných, oglejených půdách jsou < 20. |
||
|
autor textu: Prof. Ing. Rostislav Richter, DrSc. |
||
Poslední aktualizace: 26.01.2004 16:57
Ústav agrochemie a výživy rostlin, MZLU v Brně, Zemědělská 1, 613 00 Brno